Figur 1–1
Overraskende nok er det på trods af den enorme mængde arbejde, der er blevet gjort i al denne tid, muligt at fortætte den enorme masse af resultater i vid udstrækning - det vil sige at finde kærligheden, der opsummerer al vores viden. Alligevel er lovene så svære at forstå, at det er uretfærdigt over for dig at begynde at udforske dette enorme emne uden en form for kort eller omrids af forholdet mellem en del af videnskabsfaget og en anden. Efter disse indledende bemærkninger vil de første tre kapitler derfor skitsere fysikkens forhold til resten af videnskaberne, videnskabernes forhold til hinanden og videnskabens betydning for at hjælpe os med at udvikle en "følelse" for faget.
Du kan spørge, hvorfor vi ikke kan undervise i fysik ved blot at give den grundlæggende kærlighed på side et og så vise, hvordan de virker under alle mulige omstændigheder, som vi gør i euklidisk geometri, hvor vi angiver aksiomer og derefter foretager alle mulige deduktioner . (Så du er ikke tilfreds med at lære fysik på fire år, du vil lære det på fire minutter?) Vi kan ikke gøre det på denne måde af at grunde. For det første kender vi endnu ikke alle de grundlæggende kærlighed: Der er en voksende grænse for uvidenhed. For det andet involverer den korrekte udsagn af fysikkens love nogle meget ukendte ideer, som kræver avanceret matematik for deres beskrivelse. Derfor har man brug for en betydelig mængde forberedende træning selv for at lære, ordene betyder. Nej, det er ikke muligt at gøre det på den måde. Vi kan kun gøre det stykke for stykke.
Hver del, eller del, af hele naturen er altid kun en tilnærmelse til den fuldstændige sandhed eller den fuldstændige sandhed, så vidt vi kender den. Faktisk er alt, hvad vi ved, kun en form for tilnærmelse, fordi vi ved, at vi ikke kender alle lovene endnu. Derfor skal ting kun læres for at blive aflært igen eller, mere sandsynligt, for at blive rettet.
Videnskabens princip, definitionen, er næsten følgende: Testen af al viden er eksperiment . Eksperimentet er den eneste dommer over videnskabelig "sandhed". Men hvad er kilden til viden? Hvor kommer de kærlighed, der skal testes fra? Eksperimentet i sig selv hjælper med at producere disse kærlighed, i den forstand at det giver os hints. Men der er også behov for fantasi til at skabe de store generaliseringer ud fra disse antydninger - at få de vidunderlige, enkle, men meget mærkelige mønstre under dem alle, og derefter eksperimentere for igen at kontrollere, om vi har lavet det rigtige gæt. Denne forestillingsproces er så vanskelig, at der er en arbejdsdeling i fysik: der er teoretiskefysikere, der forestiller sig, udleder og gætter på nye kærlighed, men ikke eksperimenterer; og så er der eksperimentelle fysiske, der eksperimenterer, forestiller sig, udleder og gætter.
Vi sagde, at naturlovene er omtrentlige: at vi først finder de "forkerte", og derefter finder vi de "rigtige". Hvordan kan et eksperiment være "forkert"? For det første på en triviel måde: hvis der er noget galt med apparatet, som du ikke har bemærket. Men disse ting er let at fikse og tjekke frem og tilbage. Så uden at snuppe så små ting, hvordan kan resultaterne af et eksperiment være forkerte? Kun ved at være uøjagtig. For eksempel ser massen af en genstand aldrig ud til at ændre sig: en snurretop har samme vægt som en stillestående. Så en "lov" blev opfundet: masse er konstant, uafhængig af hastighed. Den "lov" viser sig nu at være forkert. Massen viser sig at stige med hastigheden, men mærkbare stigninger kræver hastigheder nær lysets. En sandLoven er: hvis en genstand bevæger sig med en hastighed på mindre end hundrede miles i sekundet, er massen konstant inden for en del i en million. I en sådan omtrentlig form er dette en korrekt lov. Så i praksis kan man mene, at den nye lov ikke gør nogen væsentlig forskel. Nå, ja og nej. For almindelige hastigheder kan vi helt sikkert glemme det og bruge den simple konstantmasselov som en god tilnærmelse. Men for høje hastigheder tager vi fejl, og jo højere hastighed, jo mere forkert tager vi.
Endelig, og mest interessant, er vi filosofisk fuldstændig forkerte med den tilnærmede lov. Hele vores billede af verden skal ændres, mens massen kun ændrer sig en lille smule. Dette er en meget ejendommelig ting ved filosofien eller ideerne bag lovene. Selv en meget lille effekt kræver nogle gange dybtgående ændringer i vores ideer.
Hvad skal vi først lære? Skal vi undervise i den korrekte , men ukendte lov med dens mærkelige og vanskelige konceptuelle ideer, for eksempel relativitetsteorien, firedimensionel rumtid og så videre? Eller skal vi først lære den simple "konstantmasse"-lov, som kun er omtrentlig, men ikke involverer så vanskelige ideer? Den første er mere spændende, mere vidunderlig og sjovere, men den anden er lettere at få i gang og er et første skridt til en reel forståelse af den første idé. Dette punkt dukker op igen og igen i undervisningen i fysik. På forskellige tidspunkter bliver vi nødt til at løse det på forskellige måder, men på hvert trin er det værd at lære, hvad der nu er kendt, hvor nøjagtigt det er, hvordan det passer ind i alt andet, og hvordan det kan ændres, når vi lærer mere.
Lad os nu fortsætte med vores skitse, eller generelle kort, over vores forståelse af videnskab i dag (især fysik, men også af andre videnskaber i periferien), så når vi senere koncentrerer os om et bestemt punkt, vil vi have en ide om baggrunden , hvorfor netop det punkt er interessant, og hvordan det passer ind i den store struktur. Så hvad er vores overordnede billede af verden?
Figur 1–1
For at illustrere kraften af atomideen, antag, at vi har en dråbe vand en kvart tomme på siden. Hvis vi ser på det meget nøje, ser vi intet andet end vand - glat, kontinuerligt vand. Selv hvis vi forstørrer det med det bedste optiske mikroskop, der er til rådighed - omkring to tusinde gange - så vil vanddråben være omkring 40 fod på tværs, omtrent lige så stor som et stort rum, og hvis vi kiggede ret godt efter, ville vi stadigse relativt glat vand - men hist og her svømmer små fodboldformede ting frem og tilbage. Meget interessant. Disse er paramecia. Du kan stoppe på dette tidspunkt og blive så nysgerrig på paramecia med deres slingrende flimmerhår og snoede kroppe, at du ikke går længere, undtagen måske for at forstørre parameciaen endnu mere og se indad. Dette er selvfølgelig et emne for biologi, men for nutiden går vi videre og ser endnu nærmere på selve vandmaterialet og forstørrer det to tusinde gange igen. Nu strækker vanddråben sig omkring femten miles på tværs, og hvis vi ser meget nøje på den, ser vi en slags myldrende, noget der ikke længere har et glat udseende - det ligner noget som en menneskemængde til en fodboldkamp sat fra en meget stor afstand. For at se, hvad dette myldrende handler om, 1-1. Dette er et billede af vand forstørret en milliard gange, men idealiseret på flere måder. For det første tegnes partiklerne på en enkel måde med skarpe kanter, hvilket er unøjagtigt. For det andet er de for nemheds skyld skitseret næsten skematisk i et todimensionelt arrangement, men de bevæger sig selvfølgelig rundt i tre dimensioner. Bemærk, at der er to slags "klatter" eller cirkler, der repræsenterer atomerne oxygen (sort) og brint (hvid), og at hver oxygen har to hydrogenatomer bundet til sig. (Hver lille gruppe af et ilt med dets to hydrogenatomer kaldes et molekyle.) Billedet er idealiseret yderligere ved, at de virkelige partikler i naturen konstant jiggler og hopper, drejer og vrider sig om hinanden. Du bliver nødt til at forestille dig dette som et dynamisk snarere end et statisk billede. En anden ting, der ikke kan illustreres på en tegning, er, at partiklerne er "klæbet sammen" - at de trækker hinanden, denne trækkes af den, osv. Hele gruppen er "limet sammen", så at sige. På den anden side klemmer partiklerne sig ikke igennem hinanden. Hvis du forsøger at trykke på dem for tæt sammen, afviser de.
Atomerne er \(1*10^{-8}\) eller \(2*10^{−8}\) cm i radius. Nu kaldes \(10^{−8}\) cm en ångstrøm (ligesom et andet navn), så vi siger, at de er 1 eller 2 ångstrøm (Å) i radius. En anden måde at huske deres størrelse på er denne: Hvis et æble forstørres til jordens størrelse, så er atomerne i æblet omtrent på størrelse med det originale æble.
Forestil dig nu denne store dråbe vand med alle disse jiggling-partikler klistret sammen og mærker sammen med hinanden. Vandet holder sit volumen; det falder ikke fra hinanden, på grund af molekylernes tiltrækning af hinanden. Står dråben på en skråning, hvor den kan bevæge sig fra et sted til et andet, vil vandet strømme, men det forsvinder ikke bare – tingene flyver ikke bare fra hinanden – på grund af den molekylære tiltrækning. Nu er jiggling-bevægelsen, hvad vi repræsenterer som varme : når vi øger temperaturen, øger vi bevægelsen. Hvis vi opvarmer vandet, stiger jigglingen, og volumen mellem atomerne øges, og hvis opvarmningen fortsætter, kommer der et tidspunkt, hvor trækket mellem molekylerne ikke er nok til at holde dem sammen, og det gør de.flyve fra hinanden og blive adskilt fra hinanden. Det er selvfølgelig sådan, vi fremstiller damp ud af vand - ved at øge temperaturen; partiklerne flyver fra hinanden på grund af den øgede bevægelse.
Figur 1–2
I fig. 1–2 har vi et billede af damp. Dette billede af damp fejler i én henseende: Ved almindeligt atmosfærisk tryk ville der bestemt ikke være så mange som tre vandmolekyler i denne figur. De fleste firkanter i denne størrelse ville ikke indeholde nogen - men vi har ved et uheld to en halv eller tre på billedet (bare så det ikke bliver helt tomt). I tilfælde af damp ser vi nu de karakteristiske molekyler tydeligere end i tilfældet med vand. For nemheds skyld tegnes molekylerne, så der er en \(120^o\) vinkel mellem brintatomerne. Faktisk er vinklen \(105^o3'\), og afstanden mellem et brints centrum og iltens centrum er 0,957 Å, så vi kender dette molekyle meget godt.
Lad os se, hvad nogle af egenskaberne ved dampdamp eller enhver anden gas er. Molekylerne, der er adskilt fra hinanden, vil hoppe mod væggene. Forestil dig et rum med et antal tennisbolde (et hundrede eller deromkring), der hopper rundt i evig bevægelse. Når de bombarderer muren, skubber dette muren væk. (Selvfølgelig skulle vi skubbe væggen tilbage.) Det betyder, at gassen udøver en nervøs kraft, som vores grove sanser (ikke at blive forstørret en milliard gange) kun føler som et gennemsnitligt skub . For at begrænse en gas skal vi påføre et tryk. Figur 1–3viser en standardbeholder til at holde gasser (brugt i alle lærebøger), en cylinder med et stempel i. Nu gør det ingen forskel, hvad formen på vandmolekyler er, så for nemheds skyld tegner vi dem som tennisbolde eller små prikker. Disse ting er i evig bevægelse i alle retninger. Så mange af dem rammer det øverste stempel hele tiden, at for at forhindre, at det tålmodigt bliver slået ud af tanken af dette kontinuerlige bank, bliver vi nødt til at holde stemplet nede med en vis kraft, som vi kalder trykket (virkelig, trykket gange arealet er kraften). Det er klart, at kraften er proportional med arealet, for hvis vi øger arealet, men holder antallet af molekyler pr. kubikcentimeter det samme, øger vi antallet af kollisioner med stemplet i samme forhold, som arealet blev forøget.
Figur 1–3
Lad os nu lægge dobbelt så mange molekyler i denne tank, for at fordoble densiteten, og lade dem have samme hastighed, dvs. den samme temperatur. Så vil antallet af kollisioner til en tæt tilnærmelse blive fordoblet, og da hver enkelt vil være lige så "energisk" som før, er trykket proportionalt med tætheden. Hvis vi betragter den sande natur af kræfterne mellem atomerne, ville vi forvente et lille fald i trykket på grund af tiltrækningen mellem atomerne og en lille stigning på grund af det endelige volumen, de optager. Ikke desto mindre, til en fremragende tilnærmelse, hvis tætheden er lav nok til, at der ikke er mange atomer, er trykket proportionalt med densiteten .
Vi kan også se noget andet: Hvis vi øger temperaturen uden at ændre gassens tæthed, altså hvis vi øger atomernes hastighed, hvad skal der så ske med trykket? Tja, atomerne rammer hårdere, fordi de bevæger sig hurtigere, og derudover rammer de oftere, så trykket stiger. Du kan se, hvor enkle ideerne om atomteori er.
Lad os overveje en anden situation. Antag at stemplet bevæger sig indad, så atomerne langsomt komprimeres til et mindre rum. Hvad sker der, når et atom rammer det bevægelige stempel? Den tager åbenbart fart efter sammenstødet. Du kan prøve det ved for eksempel at hoppe en pingpongbold fra en fremadgående pagaj, og du vil opdage, at den kommer af med mere fart end den, den slog med. (Særligt eksempel: hvis et atom tilfældigvis står stille, og stemplet rammer det, vil det helt sikkert bevæge sig.) Så atomerne er "varmere", når de kommer væk fra stemplet, end de var før de ramte det. Derfor vil alle de atomer, der er i karret, have taget fart. Det betyder, at når vi komprimerer en gas langsomt, stiger gassens temperatur . Altså under langsom komprimering, vil en gas stige i temperatur, og under langsom ekspansion vil den falde i temperatur.
Figur 1–4
Vi vender nu tilbage til vores vanddråbe og kigger i en anden retning. Antag, at vi sænker temperaturen på vores dråbe vand. Antag, at jigglingen af molekylerne af atomerne i vandet er støt aftagende. Vi ved, at der er tiltrækningskræfter mellem atomerne, så de efter et stykke tid ikke vil kunne jiggle så godt. Hvad der vil ske ved meget lave temperaturer er angivet i fig. 1-4 : Molekylerne låser sig ind i et nyt mønster, som er is . Dette særlige skematiske diagram af is er forkert, fordi det er i to dimensioner, men det er rigtigt kvalitativt. Det interessante er, at materialet har en bestemt plads for hvert atom, og du kan nemt forstå, at hvis vi på en eller anden måde skulle holde alle atomerne i den ene ende af dråben i et bestemt arrangement, hvert atom på et bestemt sted, så på grund af strukturen af indbyrdes forbindelser, som er stiv, den anden ende miles væk (i vores forstørrede skala) vil have en bestemt placering. Så hvis vi holder en isnål i den ene ende, modstår den anden ende, at vi skubber den til side, i modsætning til tilfældet med vand, hvor strukturen nedbrydes på grund af den øgede jiggling, så atomerne alle bevæger sig rundt på forskellige måder. Forskellen mellem faste stoffer og væsker er altså, at i et fast stof er atomerne arrangeret i en slags array, kaldet en krystallinsk array, og de har ikke en tilfældig position på lange afstande; placeringen af atomerne på den ene side af krystallen bestemmes af andre atomer millioner af atomer væk på den anden side af krystallen. Figur 1-4 er et opfundet arrangement for is, og selvom det indeholder mange af de korrekte træk ved is, er det ikke det sande arrangement. Et af de korrekte træk er, at der er en del af symmetrien, der er sekskantet. Det kan du se, hvis vi drejer billedet om en akse ved \(60^o\), vender billedet tilbage til sig selv. Så der er en symmetri i isen, som er årsag til snefnugs sekssidede udseende. En anden ting, vi kan se fra fig. 1-4 , er, hvorfor isen krymper, når den smelter. Det særlige krystalmønster af is, der er vist her, har mange "huller" i sig, ligesom den sande isstruktur. Når organisationen bryder sammen, kan disse huller være optaget af molekyler. De fleste simple stoffer, med undtagelse af vand og type metal, udvider sig ved smeltning, fordi atomerne er tæt pakket i den faste krystal og ved smeltning har brug for mere plads til at jiggle rundt, men en åben struktur kollapser, som i tilfældet med vand.
Selvom is har en "stiv" krystallinsk form, kan dens temperatur ændre sig - is har varme. Hvis vi ønsker det, kan vi ændre mængden af varme. Hvad er varmen i tilfælde af is? Atomerne står ikke stille. De ryster og vibrerer. Så selvom der er en bestemt rækkefølge til krystallen - en bestemt struktur - vibrerer alle atomerne "på plads." Når vi øger temperaturen, vibrerer de med større og større amplitude, indtil de ryster sig selv ud af deres plads. Vi kalder dette smeltning . Når vi sænker temperaturen, falder og falder vibrationen, indtil der ved det absolutte nulpunkt er en minimumsmængde af vibrationer, som atomerne kan have, men ikke nul. Denne minimale mængde bevægelse, som atomer kan have, er ikke nok til at smelte et stof, med en undtagelse: helium. Helium reducerer blot de atomare bevægelser så meget som det kan, men selv ved det absolutte nulpunkt er der stadig nok bevægelse til at forhindre det i at fryse. Helium fryser ikke, selv ved det absolutte nulpunkt, medmindre trykket er gjort så stort, at det får atomerne til at klemme sammen. Hvis vi øger trykket, kan vi få det til at størkne.
Figur 1–5
Så meget for beskrivelsen af faste stoffer, væsker og gasser fra et atomsynspunkt. Atomhypotesen beskriver dog også processer , og derfor skal vi nu se på en række processer fra et atomsynspunkt. Den første proces, som vi skal se på, er forbundet med vandets overflade. Hvad sker der ved vandets overflade? Vi skal nu gøre billedet mere kompliceret - og mere realistisk - ved at forestille os, at overfladen er i luft. Figur 1–5 viser overfladen af vand i luft. Vi ser vandmolekylerne som før, der danner en mængde flydende vand, men nu ser vi også vandets overflade. Over overfladen finder vi en række ting: Først og fremmest er der vandmolekyler, som i damp. Dette er vanddamp, som altid findes over flydende vand. (Der er en ligevægt mellem dampdampen og vandet, som vil blive beskrevet senere.) Derudover finder vi nogle andre molekyler - her klistrer to oxygenatomer sammen af sig selv og danner et oxygenmolekyle , der klistrer to nitrogenatomer også sammen for at danne et nitrogenmolekyle. Luft består næsten udelukkende af nitrogen, ilt, noget vanddamp og mindre mængder kuldioxid, argon og andre ting. Så over vandoverfladen er luften, en gas, der indeholder noget vanddamp. Hvad sker der nu på dette billede? Molekylerne i vandet vakler altid rundt. Fra tid til anden bliver en på overfladen tilfældigvis ramt lidt hårdere end normalt og bliver slået væk. Det er svært at se det ske på billedet, fordi det er en stillbillede . Men vi kan forestille os, at et molekyle nær overfladen lige er blevet ramt og flyver ud, eller måske et andet er blevet ramt og flyver ud. Således, molekyle for molekyle, forsvinder vandet - det fordamper. Men hvis vi lukkerkarret ovenover, vil vi efter et stykke tid finde et stort antal vandmolekyler blandt luftmolekylerne. Fra tid til anden kommer et af disse dampmolekyler flyvende ned til vandet og sætter sig fast igen. Så vi ser, at det, der ligner en død, uinteressant ting - et glas vand med et låg, der har stået der i måske tyve år - virkelig indeholder et dynamisk og interessant fænomen, som foregår hele tiden. For vores øjne, vores rå øjne, ændrer intet sig, men hvis vi kunne se det en milliard gange forstørret, ville vi se, at det fra sit eget synspunkt altid ændrer sig: molekyler forlader overfladen, molekyler kommer tilbage.
Hvorfor ser vi ingen forandring ? Fordi der forlader lige så mange molekyler, som der kommer tilbage! I det lange løb "der der ikke ske noget". Hvis vi så tager toppen af karret af og blæser den fugtige luft væk og erstatter den med tør luft, så er antallet af molekyler, der forlader det, præcis det samme, som det var før, fordi det afhænger af vandets jiggling, men antallet, der vender tilbage, er stærkt reduceret, fordi der er så mange færre vandmolekyler over vandet. Derfor går der flere ud end der kommer ind, og vandet fordamper. Derfor, hvis du ønsker at fordampe vand, tænd for ventilatoren!
Her er noget andet: Hvilke molekyler forlader? Når et molekyle forlader det, skyldes det en tilfældig, ekstra ophobning af en lille smule mere end almindelig energi, som det har brug for, hvis det skal bryde væk fra sine naboers attraktioner. Derfor, da dem, der forlader, har mere energi end gennemsnittet, har de, der er tilbage, mindre gennemsnitlig bevægelse, end de havde før. Så væsken afkøles gradvist hvis det fordamper. Selvfølgelig, når et dampmolekyle kommer fra luften til vandet nedenfor, er der en pludselig stor tiltrækning, når molekylet nærmer sig overfladen. Dette fremskynder det indkommende molekyle og resulterer i generering af varme. Så når de går, tager de varmen væk; når de kommer tilbage, genererer de varme. Når der ikke er nogen nettofordampning, er resultatet selvfølgelig ingenting - vandet ændrer ikke temperatur. Hvis vi blæser på vandet for at opretholde en kontinuerlig overvægt i antallet af fordampning, så afkøles vandet. Blæs derfor suppe på for at afkøle den!
Selvfølgelig skal du indse, at de netop beskrevne processer er mere komplicerede, end vi har angivet. Ikke alene går vandet i luften, men også fra tid til anden vil et af ilt- eller nitrogenmolekylerne komme ind og "fare vild" i massen af vandmolekyler og arbejde sig ind i vandet. Saaledes opløses Luften i Vandet; ilt- og nitrogenmolekyler vil arbejde sig ind i vandet, og vandet vil indeholde luft. Hvis vi pludselig tager luften væk fra karret, så vil luftmolekylerne forlade hurtigere, end de kommer ind, og derved danne bobler. Dette er meget dårligt for dykkere, som du måske ved.
Figur 1–6
Figur 1–7
Nu går vi videre til en anden proces. På fig. 1-6 ser vi fra et atomsynspunkt et fast stof, der opløses i vand. Hvis vi putter en krystal af salt i vandet, hvad vil der så ske? Salt er et fast stof, en krystal, et organiseret arrangement af "saltatomer". Figur 1-7 er en illustration af den tredimensionelle struktur af almindeligt salt, natriumchlorid. Strengt taget er krystallen ikke lavet af atomer, men af det vi kalder ioner. En ion er et atom, som enten har et par ekstra elektroner eller har mistet nogle få elektroner. I en saltkrystal finder vi klorioner (kloratomer med en ekstra elektron) og natriumioner (natriumatomer, hvor en elektron mangler). Ionerne klæber alle sammen ved elektrisk tiltrækning i det faste salt, men når vi putter dem i vandet, opdager vi, på grund af det negative ilt og positive brint til ionerne, at nogle af ionerne vipper løs. I fig. 1–6 ser vi en klorion blive løs, og andre atomer flyde i vandet i form af ioner. Dette billede er lavet med en vis omhu. Læg for eksempel mærke til, at vandmolekylernes brintender er mere tilbøjelige til at være i nærheden af chlorionen, mens vi nær natriumionen er mere tilbøjelige til at finde iltenden, fordi natrium er positivt og iltenden af vandet er negativ, og de tiltrækker elektrisk. Kan vi af dette billede se, om saltet opløses i vand eller krystalliserer ud af vand? Det kan vi selvfølgelig ikke sige, for mens nogle af atomerne forlader krystallen, slutter andre atomer sig til den igen. Processen er en dynamiken, ligesom ved fordampning, og det afhænger af, om der er mere eller mindre salt i vandet end den mængde, der skal til for ligevægt. Med ligevægt mener vi den situation, hvor hastigheden, hvormed atomer forlader, netop matcher den hastighed, hvormed de vender tilbage. Hvis der næsten ikke er salt i vandet, forlader flere atomer end vender tilbage, og saltet opløses. Hvis der derimod er for mange "saltatomer", vender der flere tilbage end forlader, og saltet krystalliserer.
I forbifarten nævner vi, at begrebet et molekyle af et stof kun er omtrentligt og kun eksisterer for en bestemt klasse af stoffer. Det er tydeligt i tilfælde af vand, at de tre atomer faktisk er klæbet sammen. Det er ikke så tydeligt i tilfælde af natriumchlorid i det faste stof. Der er bare et arrangement af natrium- og klorioner i et kubisk mønster. Der er ingen naturlig måde at gruppere dem som "saltmolekyler."
For at vende tilbage til vores diskussion af opløsning og udfældning, hvis vi øger temperaturen af saltopløsningen, så øges hastigheden, hvormed atomer fjernes, og det samme er hastigheden, hvormed atomer bringes tilbage. Det viser sig generelt at være meget svært at forudsige, hvilken vej det vil gå, om mere eller mindre af det faste stof vil opløses. De fleste stoffer opløses mere, men nogle stoffer opløses mindre, når temperaturen stiger.
Figur 1–8
Kulstofatomerne formodes at være i en fast krystal (som kunne være grafit eller diamant 2). Nu kan for eksempel et af iltmolekylerne komme over til kulstoffet, og hvert atom kan opfange et kulstofatom og flyve af sted i en ny kombination - "kulstof-ilt" - som er et molekyle af gassen kaldet kulstof monoxid. Det får det kemiske navn CO. Det er meget enkelt: Bogstaverne "CO" er praktisk talt et billede af det molekyle. Men kulstof tiltrækker ilt meget mere end ilt tiltrækker ilt eller kulstof tiltrækker kulstof. Derfor kan ilten i denne proces ankomme med kun lidt energi, men ilten og kulstoffet vil snappe sammen med en enorm hævn og tumult, og alt i nærheden af dem vil opsamle energien. Der genereres således en stor mængde bevægelsesenergi, kinetisk energi. Dette brænder selvfølgelig ; vi får varme fra kombinationen af ilt og kulstof. Varmen er normalt i form af den varme gass molekylære bevægelse, men under visse omstændigheder kan den være så enorm, at den genererer lys . Sådan får man flammer .
Derudover er kulilten ikke helt tilfreds. Det er muligt for den at vedhæfte en anden ilt, så vi måske får en meget mere kompliceret reaktion, hvor ilten forenes med kulstoffet, samtidig med at der sker en kollision med et kuliltemolekyle. Et oxygenatom kunne binde sig til CO og i sidste ende danne et molekyle, der består af et kulstof og to oxygener, som er betegnet \(CO_2\)og kaldes kuldioxid. Hvis vi forbrænder kulstoffet med meget lidt ilt i en meget hurtig reaktion (f.eks. i en bilmotor, hvor eksplosionen er så hurtig, at der ikke er tid til, at den kan lave kuldioxid), dannes der en betragtelig mængde kulilte. Ved mange sådanne omlejringer frigives en meget stor mængde energi, der danner eksplosioner, flammer osv. afhængigt af reaktionerne. Kemikere har studeret disse arrangementer af atomerne og fundet ud af, at hvert stof er en form for arrangement af atomer .
For at illustrere denne idé, lad os overveje et andet eksempel. Hvis vi går ind i et felt med små violer, ved vi, hvad "den lugt" er. Det er en slags molekyle eller arrangement af atomer, der har arbejdet sig ind i vores næser. Først og fremmest, hvordan fungerede det? Det er ret nemt. Hvis lugten er en slags molekyle i luften, der kibler rundt og bliver banket hver vej, kan den ved et uheld have arbejdet sig ind i næsen. Den har bestemt ikke noget særligt ønske om at komme ind i vores næse. Det er blot en hjælpeløs del af en jostende skare af molekyler, og i dens formålsløse vandringer finder denne særlige del af stof tilfældigvis sig selv i næsen.
Figur 1–9
Nu kan kemikere tage specielle molekyler som lugten af violer og analysere dem og fortælle os det nøjagtige arrangement af atomerne i rummet. Vi ved, at kuldioxid-molekylet er lige og symmetrisk: O—C—O. (Det kan også let bestemmes ved fysiske metoder.) Men selv for de langt mere komplicerede arrangementer af atomer, der er i kemien, kan man ved en lang, bemærkelsesværdig proces med detektivarbejde, finde atomernes arrangementer . Figur 1–9 er et billede af luften i nærheden af en viol; igen finder vi nitrogen og ilt i luften og vanddamp. (Hvorfor er der vanddamp? Fordi violen er våd. Alle planter transpirerer.) Men vi ser også et "monster" sammensat af kulstofatomer, brintatomer og oxygenatomer, som har valgt et bestemt bestemt mønster, som de skal arrangeres i. Det er et meget mere kompliceret arrangement end kuldioxidens; faktisk er det et enormt kompliceret arrangement. Desværre kan vi ikke forestille os alt, hvad der virkelig er kendt om det kemisk, fordi den præcise placering af alle atomer er faktisk kendt i tre dimensioner, mens vores billede er i kun to dimensioner. De seks kulstoffer, der danner en ring, danner ikke en flad ring, men en slags "rynket" ring. Alle vinkler og afstande er kendte. Altså en kemisk formeler blot et billede af et sådant molekyle. Når kemikeren skriver sådan noget på tavlen, forsøger han at "tegne", groft sagt, i to dimensioner. For eksempel ser vi en "ring" af seks kulstofatomer og en "kæde" af kulstofatomer hængende på enden, med en ilt sekund fra enden, tre hydrogenatomer bundet til det kulstof, to kulstofatomer og tre hydrogenatomer stikker op her osv. .
Figur 1–10
Hvordan finder kemikeren ud af, hvad arrangementet er? Han blander flasker fulde af ting sammen, og hvis det bliver rødt, fortæller det ham, at det består af en brint og to carbonatomer bundet på her; bliver det derimod blåt, er det slet ikke sådan det er. Dette er et af de mest fantastiske stykker detektivarbejde, der nogensinde er blevet udført - organisk kemi. For at opdage arrangementet af atomerne i disse enormt komplicerede arrays ser kemikeren på, hvad der sker, når han blander to forskellige stoffer sammen. Fysikeren kunne aldrig helt tro, at kemikeren vidste, hvad han talte om, da han beskrev atomernes arrangement. I omkring tyve år har det i nogle tilfælde været muligt at se på sådanne molekyler (ikke helt så komplicerede som dette, men nogle som indeholder dele af det) ved en fysisk metode,at måle hvor de er . Og lo og se!, kemikerne har næsten altid ret.
Det viser sig faktisk, at der i lugten af violer er tre lidt forskellige molekyler, som kun adskiller sig i arrangementet af brintatomerne.
Et problem med kemi er at navngive et stof, så vi ved, hvad det er. Find et navn til denne form! Ikke alene skal navnet fortælle formen, men det skal også fortælle, at her er et iltatom, der et brint - præcis hvad og hvor hvert atom er. Så vi kan forstå, at de kemiske navne skal være komplekse for at være fuldstændige. Du kan se, at navnet på denne ting i den mere komplette form, der vil fortælle dig strukturen af den, er 4-(2, 2, 3, 6 tetramethyl-5-cyclohexenyl)-3-buten-2-on, og det fortæller dig, at dette er arrangementet. Vi kan værdsætte de vanskeligheder, som kemikerne har, og også værdsætte årsagen til så lange navne. Det er ikke fordi de ønsker at være uklare, men de har et ekstremt svært problem med at forsøge at beskrive molekylerne med ord!
Hvordan ved vi , at der er atomer? Ved et af de tidligere nævnte tricks: vi laver den hypotese , at der er atomer, og det ene efter det andet kommer resultaterne ud, som vi forudsiger, som de burde, hvis ting er lavet af atomer. Der er også noget mere direkte bevis, et godt eksempel på det er følgende: Atomerne er så små, at man ikke kan se dem med et lysmikroskop – faktisk ikke engang med en elektronmikroskop. (Med et lysmikroskop kan du kun se ting, der er meget større.) Hvis nu atomerne altid er i bevægelse, f.eks. i vand, og vi putter en stor kugle af noget i vandet, en kugle meget større end atomerne, bolden vil jiggle rundt - meget som i et push-boldspil, hvor en stor, stor bold bliver skubbet rundt af en masse mennesker. Folk skubber i forskellige retninger, og bolden bevæger sig rundt på banen på en uregelmæssig måde. Så på samme måde vil den "store bold" bevæge sig på grund af ulighederne i kollisioner på den ene side til den anden, fra det ene øjeblik til det næste. Derfor, hvis vi ser på meget bittesmå partikler (kolloider) i vand gennem et fremragende mikroskop, ser vi en evig jiggling af partiklerne, som er resultatet af bombardementet af atomerne. Dette kaldes den brunske bevægelse.
Vi kan se yderligere beviser for atomer i strukturen af krystaller. I mange tilfælde stemmer de strukturer, der udledes af røntgenanalyse, i deres rumlige "former" overens med de former, der faktisk udvises af krystaller, når de forekommer i naturen. Vinklerne mellem de forskellige "flader" af en krystal stemmer overens, inden for få sekunder efter bue, med vinkler udledt ud fra den antagelse, at en krystal er lavet af mange "lag" af atomer.
Alt er lavet af atomer . Det er den centrale hypotese. Den vigtigste hypotese i hele biologien er for eksempel, at alt hvad dyr gør, gør atomer . Med andre ord er der intet, som levende ting gør, som ikke kan forstås ud fra det synspunkt, at de er lavet af atomer, der virker i overensstemmelse med fysikkens love . Dette var ikke kendt fra begyndelsen: det krævede nogle eksperimenter og teoretisering at foreslå denne hypotese, men nu er det accepteret, og det er den mest nyttige teori til at producere nye ideer inden for biologi.
Hvis et stykke stål eller et stykke salt, der består af atomer ved siden af hinanden, kan have sådanne interessante egenskaber; hvis vand – som ikke er andet end disse små klatter, kilometer på kilometer af det samme over jorden – kan danne bølger og skum og lave brusende lyde og mærkelige mønstre, når det løber over cement; hvis alt dette, hele livet af en vandstrøm, ikke kan være andet end en bunke atomer, hvor meget mere er der så muligt ? Hvis vi i stedet for at arrangere atomerne i et bestemt mønster, igen og igen gentages, ved og ved, eller endda danne små klumper af kompleksitet som lugten af violer, laver vi et arrangement, som altid er anderledesfra sted til sted, med forskellige slags atomer arrangeret på mange måder, som konstant ændrer sig, ikke gentager sig, hvor meget mere vidunderligt er det muligt, at denne ting kan opføre sig? Er det muligt, at den "ting", der går frem og tilbage foran dig, og taler til dig, er en stor kugle af disse atomer i et meget komplekst arrangement, sådan at den rene kompleksitet af den forbløffer fantasien om, hvad den kan gøre ? Når vi siger, at vi er en bunke atomer, mener vi ikke, at vi kun er en bunke atomer, for en bunke atomer, som ikke gentages fra det ene til det andet, kan godt have de muligheder, som du ser foran dig i spejlet.
De ting, som vi beskæftiger os med i videnskaben, optræder i utallige former og med en lang række egenskaber. For eksempel, hvis vi står på kysten og kigger på havet, ser vi vandet, bølgerne, der knækker, skummet, vandets brusende bevægelse, lyden, luften, vindene og skyerne, solen og blå himmel og lys; der er sand, og der er sten af forskellig hårdhed og varighed, farve og tekstur. Der er dyr og tang, sult og sygdom, og observatøren på stranden; der kan endda være lykke og tanke. Ethvert andet sted i naturen har en lignende række af ting og påvirkninger. Det er altid så kompliceret som det, uanset hvor det er. Nysgerrighed kræver, at vi stiller spørgsmål.
For eksempel: Er sandet andet end klipperne? Det vil sige, er sandet måske ikke andet end et stort antal meget små sten? Er månen en stor klippe? Hvis vi forstod klipper, ville vi så også forstå sandet og månen? Er vinden en skvulp af luften analog med vandets skvulpende bevægelse i havet? Hvilke fællestræk har forskellige bevægelser? Hvad er fælles for forskellige slags lyd? Hvor mange forskellige farver er der? Og så videre. På den måde forsøger vi gradvist at analysere alle ting, at sammensætte ting, som ved første øjekast ser anderledes ud, med håbet om, at vi måske kan reducere antallet af forskellige ting og derved forstå dem bedre.
For et par hundrede år siden blev der udtænkt en metode til at finde delvise svar på sådanne spørgsmål. Observation , fornuft og eksperimenter udgør det, vi kalder den videnskabelige metode . Vi bliver nødt til at begrænse os til en blottet beskrivelse af vores grundlæggende syn på det, der nogle gange kaldes fundamental fysik , eller grundlæggende ideer, som er opstået ved anvendelsen af den videnskabelige metode.
Hvad mener vi med at "forstå" noget? Vi kan forestille os, at denne komplicerede række af bevægende ting, som udgør "verden", er noget som et fantastisk skakspil, der spilles af guderne, og vi er iagttagere af spillet. Vi ved ikke, hvad spillereglerne er; alt, hvad vi har lov til, er at se spillet. Selvfølgelig, hvis vi ser længe nok, kan vi i sidste ende fange et par af reglerne. Spillets regler er, hvad vi mener med fundamental fysik. Selvom vi kendte alle regler, er vi måske ikke i stand til at forstå, hvorfor et bestemt træk er lavet i spillet, blot fordi det er for kompliceret, og vores sind er begrænset. Hvis du spiller skak, skal du vide, at det er nemt at lære alle reglerne, og alligevel er det ofte meget svært at vælge det bedste træk eller at forstå, hvorfor en spiller bevæger sig, som han gør. Sådan er det i naturen, kun meget mere; men vi kan i det mindste finde alle reglerne. Faktisk har vi ikke alle reglerne nu. (En gang imellem foregår der noget som rokade, som vi stadig ikke forstår.) Bortset fra at vi ikke kender alle reglerne, er det meget begrænset, hvad vi virkelig kan forklare i form af disse regler, fordi næsten alle situationer er så enorme kompliceret, at vi ikke kan følge spillets skuespil ved hjælp af reglerne, meget mindre fortælle, hvad der skal ske næste gang. Vi må derfor begrænse os til det mere grundlæggende spørgsmål om spillereglerne. Hvis vi kender reglerne, mener vi, at vi "forstår" verden.
Hvordan kan vi se, om de regler, som vi "gætter" på, virkelig er rigtige, hvis vi ikke kan analysere spillet særlig godt? Der er groft sagt tre måder. For det første kan der være situationer, hvor naturen har indrettet sig, eller vi indretter naturen til at være enkel og have så få dele, at vi kan forudsige præcis, hvad der vil ske, og dermed kan vi tjekke, hvordan vores regler fungerer. (I det ene hjørne af brættet er der måske kun nogle få skakbrikker på arbejde, og det kan vi præcist finde ud af).
En anden god måde at kontrollere regler på er i form af mindre specifikke regler, der er afledt af dem. For eksempel er reglen for en biskops træk på et skakbræt, at den kun bevæger sig på diagonalen. Man kan udlede, uanset hvor mange træk der kan foretages, at en bestemt biskop altid vil være på en rød firkant. Så uden at kunne følge med i detaljerne, kan vi altid tjekke vores idé om biskoppens bevægelse ved at finde ud af, om den altid er på en rød firkant. Det bliver det selvfølgelig i lang tid, indtil vi pludselig finder ud af, at det er på en sortkvadrat (det der selvfølgelig skete er, at den i mellemtiden blev erobret, en anden bonde blev krydset for dronning, og den blev til en biskop på en sort firkant). Sådan er det i fysik. I lang tid vil vi have en regel, der fungerer fremragende overordnet set, selv når vi ikke kan følge detaljerne, og så opdager vi måske en ny regel på et stykke tid . Set fra den grundlæggende fysiks synsvinkel er de mest interessante fænomener selvfølgelig de nye steder, de steder, hvor reglerne ikke virker – ikke de steder, hvor de virker ! Det er den måde, vi opdager nye regler på.
Den tredje måde at afgøre, om vores ideer er rigtige, er relativt grov, men sandsynligvis den mest kraftfulde af dem alle. Det vil sige ved grov tilnærmelse . Selvom vi måske ikke er i stand til at fortælle, hvorfor Alekhine flytter netop denne brik , kan vi måske nogenlunde forstå, at han samler sine brikker omkring kongen for at beskytte den, mere eller mindre, da det er det fornuftige at gøre under omstændighederne. På samme måde kan vi ofte forstå naturen, mere eller mindre, uden at kunne se, hvad hver lille brik gør, i forhold til vores forståelse af spillet.
Til at begynde med blev naturfænomenerne groft opdelt i klasser, såsom varme, elektricitet, mekanik, magnetisme, stoffers egenskaber, kemiske fænomener, lys eller optik, røntgenstråler, kernefysik, gravitation, mesonfænomener osv. Målet er imidlertid er at se fuldstændig natur som forskellige aspekter af et sæt fænomener. Det er problemet i grundlæggende teoretisk fysik i dag - at finde lovene bag eksperimentet; at slå disse klasser sammen. Historisk set har vi altid været i stand til at slå dem sammen, men som tiden går, bliver der fundet nye ting. Vi gik rigtig godt sammen, da der pludselig blev fundet røntgenbilleder. Så slog vi nogle flere sammen, og der blev fundet mesoner. Derfor ser det altid ret rodet ud på alle stadier af spillet. En hel del er sammenlagt, men der hænger altid mange ledninger eller tråde ud i alle retninger. Det er situationen i dag, som vi skal forsøge at beskrive.
Nogle historiske eksempler på sammenlægning er følgende. Tag først varme og mekanik . Når atomer er i bevægelse, jo mere bevægelse, jo mere varme indeholder systemet, og så varme og alle temperaturpåvirkninger kan repræsenteres af mekanikkens love . En anden enorm sammenlægning var opdagelsen af forholdet mellem elektricitet, magnetisme og lys, som viste sig at være forskellige aspekter af den samme ting, som vi i dag kalder det elektromagnetiske felt . En anden sammenlægning er foreningen af kemiske fænomener, forskellige stoffers forskellige egenskaber og atompartiklers opførsel, hvilket er i kemiens kvantemekanik .
Spørgsmålet er selvfølgelig, om det vil være muligt at slå alt sammen og blot opdage, at denne verden repræsenterer forskellige aspekter af én ting? Ingen ved. Det eneste, vi ved, er, at efterhånden som vi går, finder vi ud af, at vi kan slå brikker sammen, og så finder vi nogle brikker, der ikke passer, og vi bliver ved med at prøve at lægge puslespillet sammen. Om der er et begrænset antal brikker, og om der overhovedet er en grænse til puslespillet, er naturligvis uvist. Det vil aldrig blive kendt, før vi er færdige med billedet, hvis nogensinde. Det, vi ønsker at gøre her, er at se, i hvilket omfang denne sammenlægningsproces er foregået, og hvordan situationen er på nuværende tidspunkt, for at forstå grundlæggende fænomener ud fra det mindste sæt af principper. For at udtrykke det på en enkel måde,hvad er tingene lavet af, og hvor få elementer er der?
En beskrivelse af naturen er det, vi er optaget af her. Fra dette synspunkt er en gas, og faktisk alt stof, et utal af bevægelige partikler. Således kan mange af de ting, vi så, mens vi stod ved kysten, umiddelbart forbindes. Først trykket: dette kommer fra atomernes kollisioner med væggene eller hvad som helst; atomernes drift, hvis de alle i gennemsnit bevæger sig i én retning, er vind; de tilfældige indre bevægelser er varmen . Der er bølger med overskydende tæthed, hvor for mange partikler har samlet sig, og så når de skynder sig af, skubber de bunker af partikler længere ud, og så videre. Denne bølge af overskydende tæthed er lyd. Det er en kæmpe præstation at kunne forstå så meget. Nogle af disse ting blev beskrevet i det foregående kapitel.
Hvilke slags partikler er der? Der blev anset for at være på det tidspunkt: forskellige slags atomer blev i sidste ende opdaget. De havde forskellige navne forbundet med deres kemiske egenskaber.
Den næste del af problemet var, hvad er de kortrækkende kræfter? Hvorfor tiltrækker kulstof én oxygen eller måske to oxygener, men ikke tre oxygener? Hvad er maskineriet for interaktion mellem atomer? Er det gravitation? Svaret er nej. Tyngdekraften er helt for svag. Men forestil dig en kraft analog med tyngdekraften, der varierer omvendt med kvadratet på afstanden, men enormt kraftigere og har én forskel. I tyngdekraften tiltrækker alt alt andet, men forestil dig nu, at der er to slags "ting", og at denne nye kraft (som er den elektriske kraft, selvfølgelig) har den egenskab, der kan lide at frastøde , men ikke kan lide at tiltrække . Den "ting", der bærer denne stærke interaktion, kaldes ladning .
Hvad har vi så? Antag, at vi har to uligheder, der tiltrækker hinanden, et plus og et minus, og at de hænger meget tæt sammen. Antag, at vi har en anden ladning et stykke væk. Ville det føles nogen tiltrækning? Det ville næsten ikke føles som nogen , for hvis de to første er lige store, balancerer tiltrækningen for den ene og frastødningen for den anden. Derfor er der meget lidt kraft på nogen mærkbar afstand. På den anden side, hvis vi kommer meget tæt på den ekstra afgift, opstår tiltrækning , fordi frastødningen af likes og tiltrækningen af unlikes vil have tendens til at bringe unlikes tættere på hinanden og skubbe likes længere fra hinanden. Så bliver frastødningen mindreend attraktionen. Dette er grunden til, at atomerne, som er opbygget af plus og minus elektriske ladninger, føler meget lidt kraft, når de er adskilt af betydelig afstand (bortset fra tyngdekraften). Når de kommer tæt på hinanden, kan de "se indeni" hinanden og omarrangere deres ladninger, med det resultat, at de har et meget stærkt samspil. Det ultimative grundlag for en interaktion mellem atomerne er elektrisk. Da denne kraft er så enorm, vil alle plusser og alle minusser normalt mødes i en så intim kombination, som de kan. Alle ting, også os selv, er lavet af finkornede, enormt stærkt interagerende plus- og minusdele, alt sammen pænt afbalanceret. En gang imellem kan vi ved et uheld afsløre nogle få minusser eller et par plusser (normalt er det nemmere at fjerne minusser), og under disse omstændigheder finder vi elektricitetens kraft ubalanceret , og vi kan så se virkningerne af disse elektriske attraktioner.
For at give en idé om, hvor meget stærkere elektricitet er end tyngdekraften, skal du overveje to sandkorn, en millimeter på tværs, tredive meter fra hinanden. Hvis kraften mellem dem ikke var afbalanceret, hvis alt tiltrak alt andet i stedet for at kunne lide at afvise, så der ikke var nogen annullering, hvor meget kraft ville der så være? Der ville være en styrke på tre millioner tons mellem de to! Ser du, der er meget, meget lidt over- eller underskud af antallet af negative eller positive ladninger, der er nødvendige for at frembringe mærkbare elektriske effekter. Dette er selvfølgelig grunden til, at man ikke kan se forskel på en elektrisk ladet eller uladet ting – så få partikler er involveret, at de næppe gør en forskel i vægten eller størrelsen af en genstand.
Med dette billede var atomerne lettere at forstå. Man mente, at de havde en "kerne" i midten, som er positivt elektrisk ladet og meget massiv, og kernen er omgivet af et vist antal "elektroner", som er meget lette og negativt ladede. Nu går vi lidt videre i vores historie for at bemærke, at der i selve kernen blev fundet to slags partikler, protoner og neutroner, næsten af samme vægt og meget tunge. Protonerne er elektrisk ladede, og neutronerne er neutrale. Hvis vi har et atom med seks protoner inde i dets kerne, og det er omgivet af seks elektroner (de negative partikler i den almindelige stofverden er alle elektroner, og disse er meget lette sammenlignet med de protoner og neutroner, der danner kerner), ville være atom nummer seks i den kemiske tabel, og det kaldes kulstof.udenfor , og faktisk kun efter hvor mange elektroner der er. Så et stofs kemiske egenskaber afhænger kun af et antal, antallet af elektroner. (Hele listen over grundstoffer fra kemikerne kunne virkelig have heddet , , , , osv. I stedet for at sige "kulstof", kunne vi sige "grundstof seks, ” betyder seks elektroner, men da grundstofferne først blev opdaget, vidste man ikke, at de kunne nummereres på den måde, og for det andet ville det få alt til at se ret kompliceret ud. Det er bedre at have navne og symboler for disse ting. , i stedet for at ringe til alt efter nummer.)
Mere blev opdaget om den elektriske kraft. Den naturlige fortolkning af elektrisk interaktion er, at to objekter simpelthen tiltrækker hinanden: plus mod minus. Dette blev dog opdaget som en utilstrækkelig idé til at repræsentere det. En mere passende repræsentation af situationen er at sige, at eksistensen af den positive ladning i en eller anden forstand forvrænger eller skaber en "tilstand" i rummet, så når vi sætter den negative ladning ind, føles den en kraft. Denne mulighed for at frembringe en kraft kaldes et elektrisk felt. Når vi sætter en elektron i et elektrisk felt, siger vi, at den "trækkes". Vi har så to regler: (a) ladninger laver et felt, og (b) ladninger i felter har kræfter på sig og bevæger sig. Årsagen til dette vil blive tydelig, når vi diskuterer følgende fænomener: Hvis vi skulle lade en krop, f.eks. en kam, elektrisk, og derefter placere et ladet stykke papir på afstand og flytte kammen frem og tilbage, vil papiret svar ved altid at pege på kammen. Hvis vi ryster det hurtigere, vil det blive opdaget, at papiret er lidt bagud, der er en forsinkelse i handlingen. (På det første trin, når vi bevæger kammen ret langsomt, finder vi en komplikation, som er magnetisme . Magnetiske påvirkninger har at gøre med ladninger i relativ bevægelse, så magnetiske kræfter og elektriske kræfter kan virkelig henføres til ét felt, som to forskellige aspekter af nøjagtig den samme ting. Et skiftende elektrisk felt kan ikke eksistere uden magnetisme.) Hvis vi flytter det ladede papir længere ud, er forsinkelsen større. Så observeres en interessant ting. Selvom kræfterne mellem to ladede objekter skulle gå omvendt som kvadratet af afstanden, finder man, når vi ryster en ladning, at påvirkningen strækker sig meget længere ud, end vi ville gætte ved første øjekast. Det vil sige, at effekten falder langsommere end det omvendte kvadrat.
Her er en analogi: Hvis vi er i en vandpøl, og der er en flydende korkprop meget tæt på, kan vi flytte den "direkte" ved at skubbe vandet med en anden korkprop. Hvis du kun kiggede på de to propper , ville du kun se, at den ene bevægede sig med det samme som reaktion på den andens bevægelse - der er en form for " interaktion " mellem dem. Det, vi virkelig gør, er selvfølgelig at forstyrre vandet ; vandet forstyrrer så den anden korkprop . Vi kunne lave en "lov", at hvis man skubbede vandet en lille smule, ville en genstand tæt ved i vandet bevæge sig. Hvis den var længere væk, ville den anden kork naturligvis næppe flytte sig, for vi flytter vandet lokalt. På den anden side, hvis vi rykker med proppen, er der et nyt fænomen involveret, hvor vandets bevægelse flytter vandet dertil osv., og bølger bevæger sig væk, så der ved at rykke sker en indflydelse meget længere ude . en oscillerende påvirkning, som ikke kan forstås ud fra den direkte interaktion. Derfor må ideen om direkte interaktion erstattes med eksistensen af vandet, eller i det elektriske tilfælde, med det, vi kalder det elektromagnetiske felt .
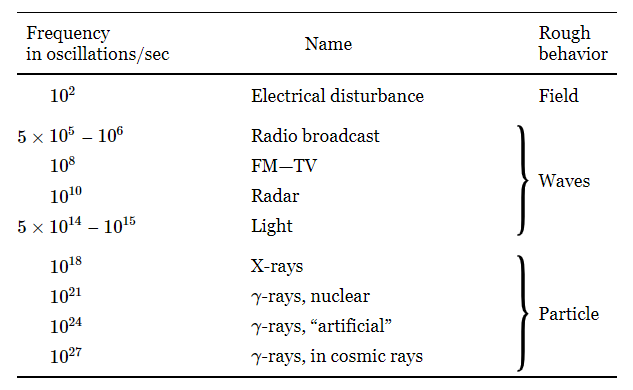
Det elektromagnetiske felt kan bære bølger; nogle af disse bølger er lys , andre bruges i radioudsendelser , men det generelle navn er elektromagnetiske bølger . Disse oscillerende bølger kan have forskellige frekvenser . Det eneste, der virkelig er forskelligt fra en bølge til en anden, er svingningsfrekvensen. Hvis vi ryster en ladning frem og tilbage hurtigere og hurtigere, og ser på effekterne, får vi en hel række af forskellige slags effekter, som alle forenes ved kun at angive ét tal, antallet af svingninger pr. sekund. Den sædvanlige "pickup", som vi får fra elektriske strømme i kredsløbene i en bygnings vægge, har en frekvens på omkring hundrede cyklusser i sekundet. Hvis vi øger frekvensen til 500 eller 1000 kilocycles ( 1 kilocycle = 1000 cycles) per sekund, er vi "i luften", for dette er frekvensområdet, som bruges til radioudsendelser. (Selvfølgelig har det intet med luften at gøre! Vi kan have radioudsendelser uden luft.) Hvis vi igen øger frekvensen, kommer vi ind i det område, der bruges til FM og TV. Når vi går endnu længere, bruger vi visse korte bølger, for eksempel til radar. Stadig højere, og vi har ikke brug for et instrument til at "se" tingene, vi kan se det med det menneskelige øje. I frekvensområdet fra \(5×10^{14}\) til \(10^{15}\) cyklusser i sekundet ville vores øjne se svingningen af den ladede kam - hvis vi kunne ryste den så hurtigt - som rødt, blåt eller violet lys, afhængigt af frekvensen. Frekvenser under dette område kaldes infrarøde og over det ultraviolette. Det faktum, at vi kan se i et bestemt frekvensområde, gør den del af det elektromagnetiske spektrum ikke mere imponerende end de andre dele fra en fysikers synspunkt, men fra et menneskeligt synspunkt er det selvfølgeligmere interessant. Går vi endnu højere op i frekvens, får vi røntgenbilleder. Røntgenstråler er intet andet end meget højfrekvent lys. Hvis vi går endnu højere, får vi gammastråler. Disse to udtryk, røntgenstråler og gammastråler, bruges næsten synonymt. Normalt kaldes elektromagnetiske stråler, der kommer fra kerner, gammastråler, mens de med høj energi fra atomer kaldes røntgenstråler, men med samme frekvens kan de ikke skelnes fysisk, uanset deres kilde. Hvis vi går til stadig højere frekvenser, for eksempel til \(10^{24}\) cyklusser per sekund, finder vi ud af, at vi kan lave disse bølger kunstigt, for eksempel med synkrotronen her hos Caltech. Vi kan finde elektromagnetiske bølger med forbløffende høje frekvenser - med endda tusind gange hurtigere oscillation - i bølgerne, der findes i kosmiske stråler. Disse bølger kan ikke kontrolleres af os.
Tabel 2-1
Det elektriske spektrum
<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<<